Die Bedeutung des Konformitätsbewertungsverfahrens für den Hersteller
Das Konformitätsbewertungsverfahren der Hersteller ist ein wichtiges Verfahren, mit dem sichergestellt wird, dass die hergestellten Produkte den geltenden rechtlichen Anforderungen und technischen Normen entsprechen. Im Rahmen des Verfahrens wird vor der Markteinführung bewertet, ob das Medizinprodukt den geltenden Anforderungen entspricht. Dabei wird geprüft, ob das Produkt alle Sicherheits-, Gesundheits- und Umweltanforderungen erfüllt und ob es den geltenden technischen Normen genügt. Ein solches Konformitätsbewertungsverfahren kann mehrere Schritte umfassen:

Klinische Daten
Hersteller von Medizinprodukten müssen die Allgemeinen Sicherheits- und Leistungsanforderungen (General Safety and Performance Requirements , GSPR) erfüllen, um den Anforderungen der EU-MDR zu entsprechen. Zu diesem Zweck müssen fortlaufend klinische Daten gesammelt und analysiert werden. Der Hersteller ist verpflichtet, Maßnahmen zu ergreifen, um ausreichende klinische Nachweise zu erbringen.
Die Häufigkeit und der Umfang der Berichterstattung hängen von der Risikoklassifizierung des Produkts ab. Einfache Produkte mit niedriger Risikoeinstufung können z.B. durch Literaturrecherche einen ausreichenden klinischen Nachweis erbringen, andere benötigen klinische Prüfungen. Eine klinische Prüfung gemäß MDR ist für Produkte der Risikoklasse III (ggf. IIb), implantierbare Produkte und Produkte ohne Äquivalenzdaten erforderlich.
Klinische Bewertung
Mit der Einführung der EU MDR 2017/745 wurden die Anforderungen an die Planung und Vorbereitung von klinischen Bewertungen deutlich verschärft. Neben der (EU-)MDR und der MEDDEV 2.7/1 Rev 4 sind auch die neuen Anforderungen an klinische Bewertungen der Koordinierungsgruppe Medizinprodukte (Medical Device Coordination Group, MDCG) zu beachten. Dabei sind insbesondere die deutlich präziser formulierten Anforderungen an die technische, biologische und klinische Ähnlichkeit zu beachten, die in bestimmten Fällen dazu führen, dass bisher genutzte publizierte Studien nicht mehr zum Nachweis von Leistung und Sicherheit herangezogen werden können.
Eine klinische Bewertung muss dabei nach einem genau definierten Verfahren erfolgen. Spätestens mit dem Inkrafttreten der EU MDR erfordert eine klinische Bewertung auch die Erstellung eines separaten klinischen Bewertungsplans (Clinical Evaluation Plan, CEP). Der Inhalt der klinischen Bewertung muss auch den Anforderungen des von den benannten Stellen verwendeten „clinical evaluation assessment report template“ entsprechen.
Klinische Prüfung
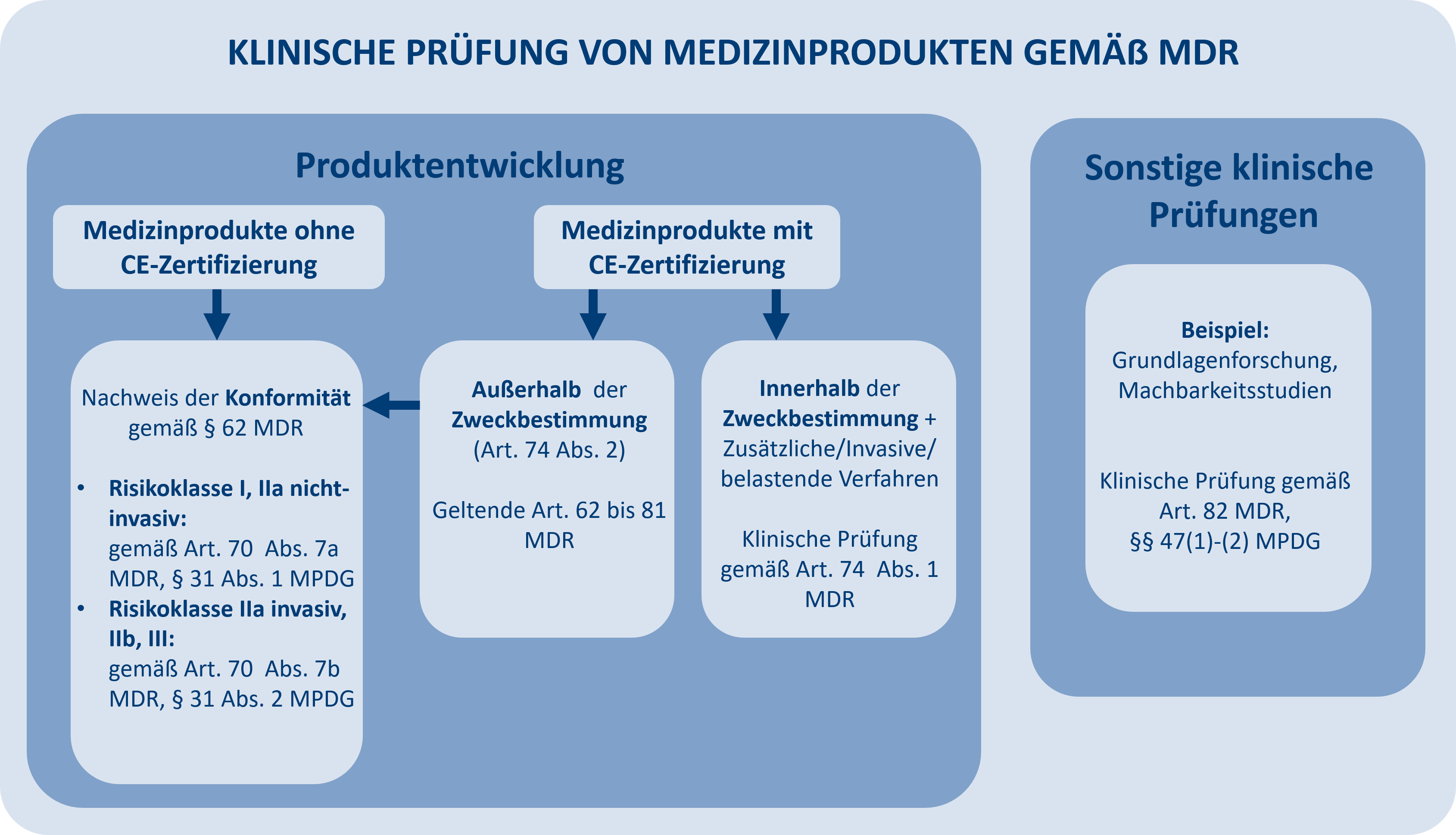
Medizinprodukte müssen klinisch geprüft werden, wenn es im Rahmen der klinischen Bewertung geschehen soll oder wenn es sich um ein Medizinprodukt handelt, das noch nicht CE-zertifiziert ist bzw. dessen Verwendung in der klinischen Prüfung nicht der ursprünglichen Zweckbestimmung entspricht. Darüber hinaus werden sonstige klinische Prüfungen mit Medizinprodukten außerhalb der Produktentwicklung durchgeführt. Artikel 82 der MDR definiert diese als klinische Prüfungen, die zu einem anderen Zweck als dem in Art. 62 (1) MDR genannten durchgeführt werden. Dazu gehören u.a. die Grundlagenforschung und Machbarkeitsstudien.
Je nach Art der klinischen Prüfung und anderen Kriterien (z. B., ob eine CE-Kennzeichnung vorhanden ist oder nicht) müssen unterschiedliche Antragsgenehmigungsverfahren durchlaufen werden.
Klinische Leistungsstudien mit IVDs werden auf der Grundlage des Clinical Performance Study Plan (CPSP) durchgeführt. Zweck der klinischen Leistungsstudien ist gemäß der IVDR die Ermittlung oder Bestätigung von Sicherheits- und Leistungsaspekten für ein Medizinprodukt. Vor allem müssen diejenigen Aspekte ermittelt werden, die zuvor nicht durch analytische und klinische Leistungsbewertungen, Literatur und/oder frühere Erfahrungen mit diagnostischen Routineuntersuchungen nachgewiesen wurden. Die gewonnenen Daten fließen in die Leistungsbewertung ein und sind ein wichtiger Bestandteil des klinischen Nachweises.
Unsere Leistungen für Sie
Als Kompetenzzentrum für Medizinprodukte in Rheinland-Pfalz unterstützt Sie das MIC gerne bei der Durchführung Ihrer klinischen Studie:
- Wir prüfen für Sie, ob eine klinische Prüfung für Ihr Medizinprodukt notwendig ist
- Wir erstellen einen Plan zur klinischen Bewertung (CEP)
- Wir führen eine systematische Literaturrecherche als Grundlage für den Aufbau Ihrer klinischen Datenbasis durch
- Durch unser Netzwerk können wir medizinische Expert:Innen und Fachwissen mit einbeziehen
- Wir unterstützen Sie bei der Implementierung und Durchführung von PMCF-Aktivitäten
Haben Sie noch weitere Fragen?
Kontaktieren Sie uns noch heute unter info@mic-mainz.de oder +49 6131 17-9646 und lassen Sie sich umfassend von unseren Experten und Expertinnen beraten.
Wir freuen uns auf Sie!
